
作為一對“強大”的技術,XL-MS和cryo-EM在結合運用中在共同彌補著各自的缺點不足。當cryo-EM圖像中分子區域定義不太清晰明確時,XL-MS就會介入,提供關于特定氨基酸殘基關鍵信息,從而可以識別蛋白質并準確推斷蛋白質結構。以下,讓我們詳細探討一下這兩種技術的發展情況,以及它們如何共同推動結構蛋白質組學領域進入一個新的時代。
蛋白質結構:“組裝機器的計劃藍圖”
蛋白質及其復合物是生物細胞的生物“主力”,調節著細胞功能不可或缺的過程,如細胞生長、細胞死亡以及細胞生命周期的各個階段。
“我喜歡將蛋白質結構與組裝機器的藍圖進行比較,”荷蘭格羅寧根大學高分辨率cryo-EM實驗室助理教授Cristina Paulino在最近的一次采訪中談到,“雖然遺傳學和生物化學有助于理解蛋白質的生理作用,但結構生物學揭示了這些納米機器的外觀以及它們的連接方式。”
因此,對這種“連接方式”的了解為科學家們提供了修復、設計和復制蛋白質,或潛在地阻斷蛋白質功能的機會——蛋白質組學的應用,預計將成為個性化醫學和現代藥理學不可或缺的組成部分。
關于XL-MS技術應用
生物學的一個基本原理是蛋白質由氨基酸殘基通過肽鍵連接形成多肽。除了肽鍵外,還存在非共價鍵,如范德華力、靜電和疏水相互作用。在結構生物學中,這些鍵很難檢測到,在原子水平上研究蛋白質結構時增加了額外的復雜性。在過去的十年中,蛋白質組學領域見證了MS技術逐漸增加豐富的一系列令人深刻的技術,其中。XL-MS技術是已證明對結構蛋白質組學不可或缺的技術之一。[1]
圖1總結了典型XL-MS的工作流程,其中,蛋白質(或其鄰近)之間的非共價鍵相互作用(或接近它們)通過用交聯試劑溶解天然蛋白質轉化為人工共價鍵。由于賴氨酸殘基的廣泛存在、在水溶液中的穩定性和高反應活性,賴氨酸殘基的伯胺基團或蛋白質的N-末端是交聯劑的常見靶標。最常用的是同位功能交聯劑包括辛二酸二琥珀酰胺(DSS)和辛二酸(磺基琥珀酰亞胺基)。[2]在交聯階段之后,蛋白質被蛋白酶加工成肽段。
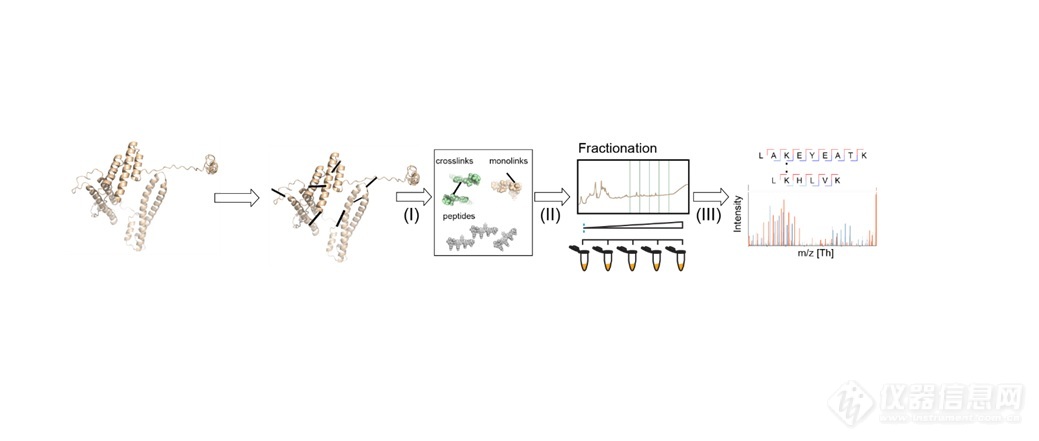
圖1:通用XL-MS工作流程。圖片來源:烏得勒支大學Heck實驗室Richard Scheltema
“隨后通過MS測量混合物進行鑒定——在大多數情況下,可以指定交聯中涉及的氨基酸,用間隔臂的長度和兩側鏈的長度定義的距離進行約束” 烏特勒支大學Heck實驗室Richard Scheltema博士解釋說,“這些距離限制提供了關于蛋白質如何折疊(兩種來自相同蛋白質的肽段)或蛋白質相互作用的有價值的信息,以及這種相互作用的界面位于何處(兩種來自不同的蛋白質肽段)。”
通常情況下,XL-MS實現的結構分辨率在15-50埃米,其分辨率無法與X射線晶體學、核磁共振(NMR)光譜學、cryo-EM等其他結構生物學技術的分辨率相匹敵。因此,這些技術必須相互補充使用。[3]
cryo-EM:提供的進一步解決方案
冷凍電鏡(cryo-EM)是由透射電鏡(TEM)發展而來的,它通過二維(2D)圖像投影來確定三維(3D)結構,同時保持樣品的完整性和結構接近原始狀態。這是通過研究玻璃化狀態下的樣品來實現的。在玻璃化狀態下,樣品的薄片迅速浸入液態乙烷溶液中,低溫保存并保護其免受TEM內的真空和輻射損傷。[4]Paulino也進一步討論了cryo-EM與其他結構生物學技術相比的優勢。
近年來,cryo-EM技術已經取得了長足的進步,這意味著許多樣品現在可以用近原子分辨率(通常為3-5埃)進行分析。[5]不幸的是,在這個分辨率范圍內,科學家們仍然難以區分和表征蛋白質復合物中所有氨基酸側鏈,這意味著重新構建模型是一項復雜的任務。“cryo-EM的使用正在大幅增加,從這項技術記錄的蛋白質結構輪廓來看,很難確定哪些蛋白質相互關聯,以及它們在整個結構中是如何排列的。而這就是XL-MS介入的地方。
XL-MS中的交聯數據描述了肽段中兩個特定氨基酸殘基之間的最大距離。將提出的蛋白質結構模型及其結構域插入由cryo-EM重構獲得的三維體中,并整合交聯數據,以驗證蛋白質復合物內特定肽的位置和方向。
將蛋白質整合到三維體中是一項艱巨而復雜的任務,需要對所涉及的蛋白質復合物及其子成分有透徹的理解。因此,Sali團隊開發了集成建模平臺(IMP),這是一個希望將XL-MS和cryo-EM結合起來的研究人員的通用工作流程平臺。
XL-MS和cryo-EM在結構生物學中被配合應用
最近,Henry等人確定了載脂蛋白E4(ApoE4)的活性結構和結合機制。ApoE4與阿爾茨海默病(AD)和心血管疾病(CVD)有關,是載脂蛋白(ApoE)的脂質化同種型,ApoE是一種蛋白質,通過充當細胞表面受體的配體,促進富含膽固醇的脂蛋白的內化。采用結合XL-MS,cryo-EM和生物信息學建模工具的混合方法,Henry等表明ApoE4存在于兩種不同的確證中,指向依賴于調節其受體結合區可及性的激活機制。作者指出,這些發現可能對于解釋蛋白質在AD和CVD中的作用以及隨后潛在治療方法的發展具有重要價值。[6]
Schmidt和Urlaub在2017年全面綜述中概述了類似的令人印象深刻的研究,包括Lührmann和Stark組對剪接體的結構表征。
2019年1月,荷蘭科學研究組織(NWO)向一個名為“細胞中蛋白質社會行為的監測和可視化”的項目撥款160萬歐元的資助,其中XL-MS和cryo-EM技術以及其他分子方法,被綜合使用。項目可視化了蛋白質之間的相互作用,該項目的主要研究人員包括Albert Heck、John van der Oost、Alexandre Bonvin、Friedrich Foerster和Scheltema等人。
“在這個項目中,我們的目標是使用(一種cryo-EM的專門應用),在選定的一組嗜熱菌中不偏倚地發現所有的蛋白質復合物。在這里,XL-MS被用來提供識別復合物內蛋白質的身份、空間順序(通常不能直接從斷層掃描數據中得到答案),以及結構模型來填補最終的空白。” Scheltema說,“之所以選擇嗜熱菌,是因為這些微生物是具有生物化學用途的蛋白質復合物的潛在寶庫。”
重新定義限制,繼續前進
總之,XL-MS和cryo-EM為結構蛋白組學領域提供了巨大的發展潛力。然而,每種技術都面臨著自己的局限性,必須克服這些局限性才能形成完美的配合使用。
“Cryo-EM不斷重新定義其局限性,但我們仍然面臨著一些挑戰,”Paulino評論道,“對于X射線晶體學來說,獲得完全可操作和維護的同步加速器束流線基本上是免費的,而cryo-EM的高成本和操作顯微鏡所需要的專業知識水平便成為一個障礙。” 在一定程度上(但并非全部),政府實施對Cryo-EM設備的補貼政策的解決了這一問題。
“冷凍斷層掃描提供了一種相對較低分辨率的蛋白質復合物視圖,直接解釋很困難。” Scheltema補充說,“另一方面,來自XL-MS的數據提供了解決方案中包含所有空間信息的視圖。然而,我認為將這兩者聯系起來是最大的挑戰,因為XL-MS提供了樣本中所有蛋白質的信息, 這需要以某種方式過濾掉由斷層掃描揭示的復合物內的蛋白質。”





